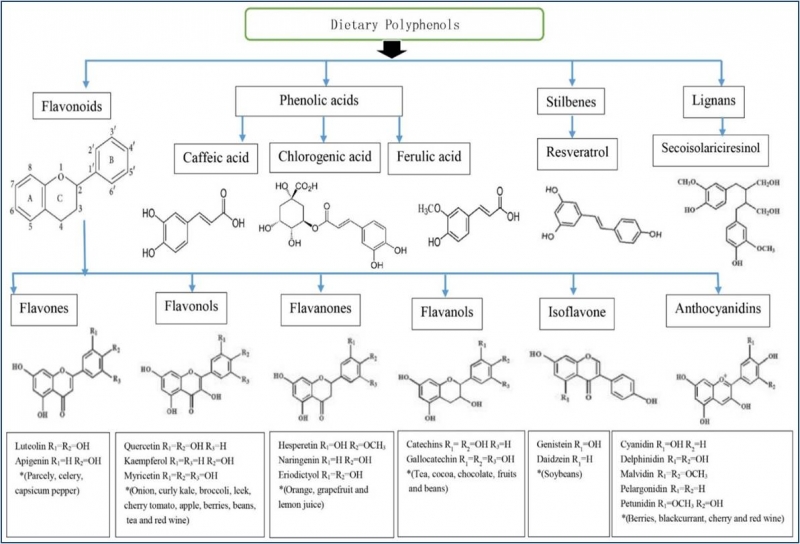
Les polyphénols appartiennent à une famille de composés phytochimiques qui figurent parmi les plus abondants dans le règne végétal. Ils sont le résultat du métabolisme secondaire des plantes par deux voies métaboliques fondamentales: la voie shikimate et la voie acétate1. Il existe actuellement environ 8 000 polyphénols différents, répartis en au moins dix classes différentes en fonction de leur structure chimique (Figure 1). Les polyphénols sont classés en i) flavonoïdes, incluant les flavones (apigénine), les flavonols (quercétine, kaempférol), les flavanones (hespérétine, Engeletine) , les flavanols (catéchine, épicatéchine, épigallocatéchine), les isoflavones (génistéine, daidzéine) et les anthocyanidines (cyanidine) et ii) non-flavonoïdes tels que les acides phénoliques (groupes de composés dérivés des acides benzoïque et hydroxycinnamique où figurent l’acide caféique, l’acide chlorogénique et l’acide ferulique), les stilbènes (comme le resvératrol) et les lignanes (comme le sécoisolaricirésinol); les tanins sont des polymères de flavonoïdes 2.
Figure 1: Place du resvératrol et de l’apigénine dans la classification des polyphénols. Le resvératrol, sous sa forme cis et trans, est un polyphénol de la classe des stylbènes. L’apigénine est un polyphénol de la classe des flavonoïdes et de la sous-classe des flavones
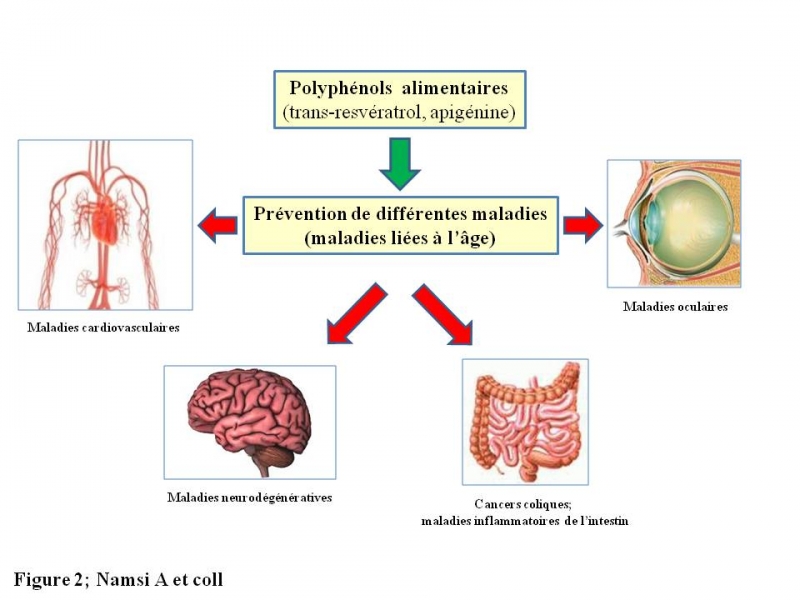
Les polyphénols, qui présentent un intérêt nutritionnel en tant que micronutriments, sont particulièrement abondants dans plusieurs aliments (légumes, fruits), les huiles (huiles d’argan et d’olive) et les boissons (vins rouges) associées au régime méditerranéen. Il existe de nombreuses preuves provenant d'études in vitro, de modèles animaux et d'études cliniques soutenant que les polyphénols pourraient avoir des activités géroprotectrices (activités anti-vieillissement) ainsi que des effets cytoprotecteurs (effets protecteurs vis-à-vis du stress oxydant, de l’inflammation et/ou de la mort cellulaire), en particulier dans les maladies liées à l'âge (Figure 2): maladies cardiovasculaires, maladies des yeux (cataracte, dégénérescence maculaire liée à l'âge (DMLA)) et certaines maladies chroniques (maladies inflammatoires de l’intestin, polyarthrite rhumatoïde) associées ou non à une augmentation des taux d’oxystérols (dérivés oxydés du cholestérol) 3. Dans ces différents types de maladies, les polyphénols exerceraient leurs activités géroprotectrices et/ou cytoprotectrices en agissant sur le contrôle des dysfonctionnements mitochondriaux, du stress oxydant, de l’inflammation, de l’angiogenèse et de la mort cellulaire 4,5.
Figure 2: Polyphénols et prévention des maladies liées à l’âge. Plusieurs études, en particulier réalisées in vitro, suggèrent que les polyphénols parmi lesquels figurent le resvératrol et l’apigénine sont potentiellement bénéfiques vis-à-vis de nombreuses maladies liées à l’âge : maladies cardiovasculaires, maladies neurodégénératives, cancers coliques et maladies inflammatoires (maladies inflammatoires de l’intestin, polyarthrite rhumatoïde) ainsi que certaines maladies oculaires comme la dégénérescence maculaire liée à l’âge (DMLA).
Au niveau du cerveau, les polyphénols pourraient prévenir l'oxytose, un type de mort cellulaire induit par le stress oxydant pouvant intervenir dans la neurodégénérescence 6,7. Il existe également de nombreuses preuves que plusieurs polyphénols ont des propriétés anti-tumorales (blocage du cycle cellulaire, induction de l'apoptose, prévention des métastases) 8. Il existe aussi des preuves récentes démontrant que les polyphénols (en particulier le trans-resvératrol, un polyphénol de la famille des stilbènes, que l’on trouve dans les raisins, et certains fruits rouges tels que les mûres) ont des propriétés différenciantes sur plusieurs types de cellules: adipocytes, cellules hématopoïétiques, cellules souches mésenchymateuses du cordon ombilical humain, cellules cancéreuses (thyroïde, glioblastome, colon), fibroblastes de poumon humain, kératinocytes, cardiomyoblastes embryonnaires et myoblastes 9,10,11,12,13,14. Il existe aussi plusieurs preuves d’après lesquelles de nombreux composants alimentaires du régime méditerranéen (curcumin, trans-resvératrol, acides gras polyinsaturés (AGPI)) et de régimes alimentaires enrichis en polyphénols et AGPI sont en mesure d’activer la neurogenèse dans le cerveau des adultes.
Il est donc séduisant de penser que des approches nutritionnelles, des aliments fonctionnels enrichis en polyphénols, ou des polyphénols fonctionnalisés (polyphénols couplés à des nanoparticules), ou encore micro- ou nano-encapsulés pourraient offrir des perspectives prometteuses pour stimuler la neurogenèse chez les seniors en particulier pour lutter contre certaines maladies neurodégénératives (maladie d’Azheimer, maladie de Parkinson) et le déclin cognitif 15,16.
En outre, plusieurs polyphénols, y compris des flavonoïdes et des non flavonoïdes ont des effets neurotropes: ils stimulent la survie neuronale et favorisent la croissance des neurites in vitro, une caractéristique de la différenciation neuronale 17. Les flavonoïdes sont également capables d'induire une différenciation neuronale des cellules souches embryonnaires de souris et des cellules souches pluripotentes humaines 18. Globalement, ces données corroborent les effets neurotrophiques des polyphénols et la capacité des polyphénols à imiter les fonctions de facteurs neurotrophiques qui sont une famille de peptides et de petites protéines (‘brain derived neurotrophic factor’ (BDNF), ‘nerve growth factor’ (NGF)) et octadécaneuropeptide (ODN)) capables de favoriser la croissance, la survie et / ou la différenciation des neurones en développement et des neurones matures 17. Contrairement aux composés peptidiques tels que les neurotrophines, les polyphénols ne sont pas dégradés dans le tractus intestinal et peuvent traverser la barrière hémato-encéphalique. Ils pourraient donc potentiellement être utilisés comme agents thérapeutiques dans des pathologies neurodégénératives associées à une perte neuronale et nécessitant ainsi de stimuler la neurogenèse, telles que les accidents ischémiques cérébraux, les maladies d'Alzheimer et de Parkinson 17,19,20.
À l'heure actuelle, alors que l'on considère que les polyphénols peuvent avoir des activités neuroprotectrices, les connaissances sont encore limitées i) sur la capacité de ces molécules à favoriser la différenciation neuronale et ii) sur les voies de signalisation qu’ils activent au cours de la différenciation. Le resvératrol sous sa forme trans, qui est un élément important du régime méditerranéen, aurait des propriétés antioxydantes et anti-tumorales, mais ses effets en tant qu'inducteur de plasticité neurale sont encore débattus 21. Quant à l’apigénine (un composé chimique de la famille des flavones, une sous-classe des flavonoïdes), il s’agit d’un polyphénol majeur du persil, qui est également largement consommé dans le régime alimentaire méditerranéen, principalement au Moyen-Orient. L'apigénine est également présente dans le thym, le romarin, le céleri et la camomille; ce polyphénol est également présent dans le miel 22 ainsi que dans l'huile d'olive 23. À l'heure actuelle, il a été démontré que l'apigénine modulait la transmission GABAergique et glutamatergique dans des neurones corticaux en culture 24. Des effets neuroprotecteurs, anti-amyloïdogènes et neurotrophiques de l'apigénine ont aussi été décrits dans un modèle murin de maladie d'Alzheimer 13. Ces effets étaient associés à une activation de la protéine de liaison aux éléments de réponse de l'adénosine monophosphate (CREB), caractérisée par un taux accru de CREB phosphorylé 13.
Au laboratoire, dans le cadre de nos travaux sur la neurodégénérescence, nous avons étudié la capacité de polyphénols à imiter l'action de composés neurotrophiques (cytoprotection et / ou différenciation). Nous avons recherché si deux polyphénols majeurs présents dans le régime alimentaire méditerranéen (trans-resvératrol et apigénine) induisaient une différenciation neuronale caractérisée par la formation de dendrites et d'axones en utilisant des cellules de neuroblastome murin N2a. Ces dernières sont des cellules cholinergiques qui se différencient en cellules cholinergiques ou dopaminergiques en fonction des conditions de culture 25,26. Fait intéressant, les cellules N2a expriment le récepteur PAC1, membre de la superfamille des récepteurs couplés à la protéine G (GPCR), y compris les récepteurs métabotropiques qui se lient à l'ODN 27,28. PAC1 et les membres de la famille des GPCR activent les voies de signalisation dépendantes de l'adényl cyclase / AMPc / PKA et de la phospholipase C (PLC) / DAG / PKC 29,30. Le récepteur PAC1 déclenche également l'activation de plusieurs autres cascades de protéines kinases telles que ERK1/2, JNK1/2, MAPK p38 et PKB31,32. Les cellules N2a ont la capacité de lier le polypeptide d'activation de l'adénylate cyclase hypophysaire (PACAP), qui est largement distribué dans le cerveau et les organes périphériques et qui présente une grande affinité pour le récepteur PAC1 33, 34,35. Les cellules N2a peuvent également être utilisées pour étudier d'autres neuropeptides ou molécules naturelles ou synthétiques capables d'interagir avec les récepteurs de la superfamille des GPCR.
Ainsi, les cellules N2a constituent un modèle approprié pour étudier la différenciation neuronale et identifier les voies de signalisation associées à ce processus.
Le modèle de cellules N2a a donc été utilisé pour évaluer les effets du trans-resvératrol et de l'apigénine sur la différenciation neuronale. Sur les cellules N2a, il a été montré que le trans-resvératrol et l’apigénine induisent la formation de dendrites et d’axones, prolongements du neurone qui conduit le signal électrique du corps cellulaire vers les zones synaptiques.. Ces résultats démontrent une activité biologique de ces polyphénols sur les cellules nerveuses. Ainsi, le trans-resvératrol et l’apigénine induisent une différenciation neuronale et présentent de ce fait une activité neurotrophique (favorisant la croissance, la survie et / ou la différenciation des neurones) considérée comme bénéfique pour le fonctionnement cérébral. Les résultats expérimentaux sont présentés en détail dans le Journal ‘Diseases33.
Les résultats que nous avons obtenus démontrent donc de nouvelles propriétés des polyphénols en mettant en évidence leur capacité à agir sur les neurones ce qui constitue une nouvelle allégation nutritionnelle pour ces micronutriments. Les polyphénols, souvent présents en quantités importantes dans le régime méditerranéen, ouvrent donc de nouvelles perspectives (via leurs activités neurotrophiques) dans le cadre de la plasticité neuronale en médecine régénérative pour prévenir et traiter des maladies neurodégénératives.
Remerciements
Amira Namsi, Dominique Vervandier-Fasseur, Hélène Greige-Georges, Lizette Auezova, Amira Zarrouk, Norbert Latruffe, Anne Vejux et Gérard Lizard sont membres de l’Association Nutrition Méditerranéenne et Santé (NMS : http://bioperoxil.u-bourgogne.fr/45-non-categorise/182-association-nms.html ). Ce travail a été présenté sous forme de communication orale au Colloque International ‘Vigne, vin, alimentation et santé’ Héraklion, Crète, 22-26 mai 2018 organisé par la chaire UNESCO ‘Culture et Tradition du Vin’ de l’Université de Bourgogne. Les auteurs remercient Nathalie Bancod pour l’aide apportée dans la mise en page de la bibliographie.