Introduction
Les levures de l’espèce Saccharomyces cerevisiae ont longtemps été considérées comme les seules levures responsables du processus de fermentation alcoolique. On sait aujourd’hui que différentes espèces de levures Saccharomyces et non-Saccharomyces (NS) sont présentes dans les moûts de raisin et qu’un certain nombre d’entre elles participe à la fermentation alcoolique. Bien qu’il soit aujourd’hui largement admis que les principales sources de levures dans le moût de raisin sont les baies de raisin et le matériel de vinification1,la part apportée par chacune de ces deux sources est encore mal définie. De plus, d’autres sources potentielles comme l’air, les insectes ou le vinificateur lui-même ont été pour le moment peu ou pas étudiées.
Les baies de raisin hébergent une vaste communauté de levures. Les genres les plus couramment identifiés sur les baies matures tels que Candida, Hanseniaspora, Metschnikowia et Pichia2 3 4 sont majoritairement ceux les plus couramment identifiés dans les moûts de raisin : Candida, Hanseniaspora, Metschnikowia et Pichia et, occasionnellement, Brettanomyces, Issatchenkia, Kluyveromyces, Rhodotorula, Schizosaccharomyces, Torulaspora et Zygosaccharomyces5 6 7 8.
Dans le cas de la levure Saccharomyces (S.) cerevisiae, beaucoup d’auteurs se sont interrogés sur l’origine des souches S. cerevisiae présentes au cours de la fermentation étant donné que cette espèce est relativement peu isolée sur le raisin9. Les différentes études réalisées confirment que les levures de l’espèce S. cerevisiae présentes au cours de la fermentation alcoolique peuvent provenir du raisin mais que la majorité d’entre elles provient d’une autre source 10 11.
Le matériel de vinification présent dans la cuverie est reconnu comme étant également une source directe pour les levures retrouvées en moûts. En effet, de nombreuses levures ont été isolées sur le matériel de cuverie avant et pendant la période des fermentations. Les principaux genres isolés sur le matériel ou les surfaces de la cuverie sont Aureobasidium, Candida, Cryptococcus, Debaryomyces, Hanseniaspora, Hansenula, Metschnikowia, Pichia, Rhodotorula, Saccharomyces et Torulaspora12 13 14 15. De plus, bien que les populations changent au cours de l’année, des levures et notamment l’espèce S. cerevisiae peuvent
toujours être isolées dans la cuverie (matériel de vinification, sols, murs…) en dehors des périodes de fermentation161718.
Le matériel ne serait donc pas juste un vecteur d’échanges de levures entre les raisins provenant de différentes parcelles et le moût de raisin, mais semble constituer un véritable réservoir de levures permettant la constitution d’une flore de cuverie19 20.
En dehors de ces études portant toutes sur S. cerevisiae, aucune étude n’a démontré les transferts de levures non-Saccharomyces (NS) du matériel de cuverie vers les moûts de raisin. Le fait qu’une partie des levures NS présentes dans les moûts proviennent du matériel de cuverie reste donc une simple hypothèse.
Les résultats qui sont présentés dans cet article ont été obtenus par C. Grangeteau21 au cours de sa thèse de Doctorat, thèse sous notre responsabilité. Entre autres objectifs, il s’agissait d’estimer quelle est la part des levures présentes dans le moût de raisin et pendant la fermentation alcoolique qui proviennent directement de la baie de raisin. La discrimination au niveau de la souche, nécessaire pour identifier l’origine des microorganismes, a été réalisée pour l’espèce S. cerevisiae mais aussi pour les espèces Starmellaria bacillaris (synonyme Candida zemplinina), Hanseniaspora (H.) guilliermondii et H. uvarum. Ces trois espèces non-Saccharomyces sont souvent majoritaires lors des premiers jours de la FA22 et peuvent donc influer fortement sur les propriétés organoleptiques des vins produits23 2425. Concernant les levures NS, pour lesquelles peu de techniques fiables permettant de discriminer un grand nombre d’échantillons sont disponibles, la spectroscopie infrarouge à transformée de Fourier (IR-TF) a été choisie. Cette technique, déjà utilisée dans d’autres environnements pour discriminer différents microorganismes au niveau du genre et de l’espèce, a été réalisée en collaboration avec D. Gerhards et C. von Wallbrunn de l’Université de Geisenheim en Allemagne afin de permettre le suivi et la détermination de l’origine des levures isolées dans les moûts et au cours de la FA pour un grand nombre d’isolats.
Origine des levures S. cerevisiae
Les raisins utilisés dans cette étude ont été récoltés (millésimes 2012 et 2013) dans une parcelle de Chardonnay plantée en 1986, appartenant au lycée viticole de Macon-Davayé située à Davayé en Saône-et-Loire (46°18'32.2"N, 4°44'17.9"E, 258 m d’altitude).
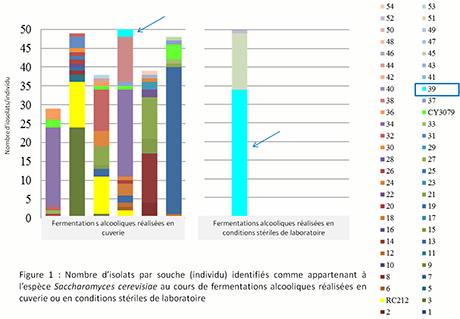
Une partie de ces raisins ont été vinifiés en cuve (Cuverie du Bureau interprofessionnel des Vins de Bourgogne, BIVB), l’autre partie prélevée aseptiquement a été vinifiée au laboratoire (IUVV, Dijon). Pour les fermentations réalisées en conditions stériles, nous avons isolé peu de levures de l’espèce S. cerevisiae (Fig. 1), et seulement 3 souches différentes ont été discriminées.
Figure 1 : nombre d’isolat par souche (individu) identifiés comme appartenant à l’espèce Saccharomyces cerevisiae au cours de fermentations alcooliques réalisées en cuverie ou en conditions stériles de laboratoire
Ce résultat confirme la présence minoritaire de l’espèce voire son absence sur les baies de raisin26 2728. En revanche, un plus grand nombre de souches ont été isolées puis identifiés en conditions de vinification cuverie. Il semble ainsi probable que des souches de levures de cette espèce s’implantent dans le moût de raisin au cours de la fermentation alcoolique et que ces souches proviennent de l’environnement de la cuverie comme déjà démontré29.
Parmi les 3 souches identifiées en conditions de laboratoire, la souche 39 est très majoritaire (54 isolats sur 93 isolats au total). Cette souche est également retrouvée au cours de la fermentation dans la cuverie. Ce résultat permet de confirmer qu’une faible proportion de souches de levures S. cerevisiae présentes au cours de la fermentation provient de la baie de raisin.
Origine des souches de levures non-Saccharomyces
Nous avons réalisé un suivi de différents individus isolés sur baies, dans le moût de raisin au cours de la fermentation en 2012 et 2013 et dans l’environnement de la cuverie (sol, air, matériel vinaire) pour l’espèce non-Saccharomyces, Hanseniaspora uvarum.
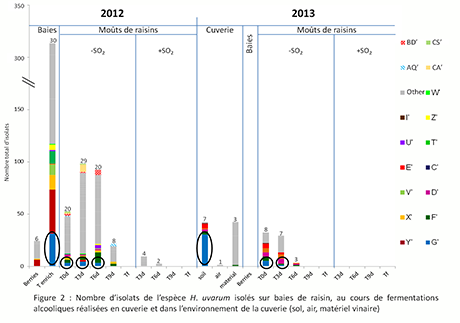
En 2012, une très grande diversité est observée pour l’espèce H. uvarum présente sur les raisins (Fig. 2). Sept souches sont communes aux deux environnements : vignoble et moûts, confirmant qu’une partie des levures non-Saccharomyces présentes en moût proviennent effectivement du vignoble. Cependant la majorité des souches (environ les 2/3) proviennent vraisemblablement de l’environnement cuverie et s’implantent dans le moût lors des étapes pré-fermentaires ou au cours de la fermentation.
En 2013, des souches de H. uvarum (6 sur le sol, 4 sur le matériel et 1 dans l’air) (Fig. 2) ont été isolées dans la cuverie avant l’arrivée de la vendange. Ces résultats confirment bien la présence de ce genre parmi d’autres dans l’environnement cuverie30 31.
Ils montrent également une diversité intra-spécifique des levures présentes dans l’environnement cuverie. Parmi ces souches, certaines avaient déjà été isolées en 2012 et ne proviennent pas du vignoble (millésime 2012). Ces résultats montrent donc pour la première fois la capacité de certaines souches de H. uvarum à persister d’un millésime à l’autre dans l’environnement cuverie. Cette capacité n’avait alors été démontrée que pour l’espèce Saccharomyces cerevisiae et l’on peut donc se demander si comme les souches de cette espèce, les levures du genre Hanseniaspora peuvent s’implanter dans les moûts après un an passé dans l’environnement cave.
Figure 2 : nombre d’isolats de l’espèce H. Uvarum isolés sur baies de raisin, au cours de fermentation alcooliques réalisées en cuverie et dans l’environnement de la cuverie (sol, air, matériel vinaire)
Aucune levure appartenant à l’espèce H. uvarum n’a, par contre, été isolée sur baie en 2013 (Fig. 2). La source la plus probable des levures H. uvarum isolées ensuite dans les moûts pour ce millésime est donc l’environnement cuverie. Six souches de H. uvarum isolées dans les moûts en 2013 correspondent effectivement à des souches retrouvées dans l’environnement avant l’arrivée de la vendange et 3 de ces 6 souches ont déjà été isolées dans les moûts en 2012 (Fig. 2). Elles ont donc survécu un an dans l’environnement cuverie avant de se réimplanter dans les moûts l’année suivante. Ces résultats montrent la forte capacité d’implantation de ces souches après un an dans l’environnement cave.
Les résultats obtenus mettent également en évidence qu’une souche isolée au vignoble en 2012 (souche G’) s’implante dans le moût au cours de la fermentation en 2012, persiste dans la cuverie entre les millésimes 2012 et 2013 et s’implante à nouveau dans le moût de raisin de l’année suivante 2013.
Conclusion
Le travail réalisé démontre pour la première fois, que la baie de raisin constitue une source limitée pour les levures non-Saccharomyces. Par contre, la cuverie semble constituer une source importante. Les levures non-Saccharomyces étudiées sont par ailleurs capables de persister d’un millésime à l’autre et ainsi de se réimplanter dans le moût de raisin l’année suivante. Le comportement des levures non-Saccharomyces s’apparente en fait à celui des levures Saccharomyces.
L’origine des levures dans le moût de raisin est donc multiple et elle ne peut, en aucun cas, se réduire pour un millésime donné qu’à la flore présente sur les baies de raisin au moment de la récolte. Les levures présentes dans l’air, sur le matériel de vinifications, sur le sol et les murs de la cuverie, dont certaines apportées lors de récoltes précédentes, participent beaucoup à la flore du moût de raisin. Même si bien évidemment les levures de la cuverie et/ou de la cave ont vraisemblablement comme origine le raisin !